- AVANT-PROPOS
- A la UNE
- PRESENTATION
- ACTUALITE SCIENTIFIQUE et TECHNOLOGIQUE
- ACTUALITE ARTISTIQUE
- BLOG
- CONSCIENCE
- PLANETE VIVANTE
- SCIENCES
- Sciences et histoire
- Science et politique
- Science/conscience
- Le COVID-19
- COVID-19 - Journal d'une pandémie - 1 -
- COVID-19 - Journal d'une pandémie - 2 -
- COVID-19 - Journal d'une pandémie - 3 -
- COVID-19 - Journal d'une pandémie - 4 -
- COVID-19 - Journal d'une pandémie - 5 -
- COVID-19 - Journal d'une pandémie -6 -
- COVID-19 - Journal d'une pandémie - 7
- COVID-19 - Journal d'une pandémie - 8
- COVID -19 - Journal d'une pandémie - 9
- COVID-19 - Journal d'une pandémie - 10
- COVID-19 - Journal d'une pandemie - 11
- Arts et sciences
- L'homme debout
- Les débuts de la sagesse
- L'épopée scientifique
- Chimie, vivant... une si longue histoire !
- Introduction : 52 choses que je sais d'elle
- Sommaire
- 1 - Premiers pas
- I - A l'origine
- II - De la tetrasomia et l'alchimie à la chimie moderne
- III - al-kimiya
- IV - Alchimie : de l'aube à la fin de la Renaissance
- V - De l'(al)chimie à la chimie : une question de méthode ?
- VI - L'alchimie selon Newton, première partie
- VII - L'alchimie selon Newton, deuxième partie
- 2 - La chimie des Lumières
- XI - Chimie au siècle des Lumières - Introduction
- XII - Chimie au siècle des Lumières- Les affinités électives
- XIII - Diderot et la chimie
- XIV - Diderot - La chimie, pourquoi ?
- XV- Diderot chimiste
- XVI- La chimie et le Rêve de D'Alembert
- 3 - La chimie du vivant
- X - Chimie et Vivant - Introduction
- XIX - La génération spontanée
- XX - Fermentation : duel à 3 !
- XXI - Stéréochimie : clé du Vivant
- XXII - Homochiralité et origine de la vie
- XXIIc - Origine de la vie : état des lieux... provisoire
- XXIIb - Des biopolymères aux premiers organismes vivants
- XXIII- Stéréochimie et activité biologique
- XXIV - Chimie du cerveau - 1- Un cerveau, trois cerveaux, des cerveaux...
- XXV - Chimie du cerveau - 2 - Les neurotransmetteurs, messagers chimiques
- XXVI- Chimie du cerveau -3- Rôle des différents neurotransmetteurs
- XXXIV - Odorat, Odeurs et parfums
- XXXV- Bonnes et mauvaises odeurs
- XXXVI - Chimie et parfums
- XLIII - Chimie et couleur -1- De colore
- XLIV - Chimie et couleur -2- Couleurs végétales
- XLV - Chimie et couleur -3- : chimiothérapie et colorants
- XL- a - ADN, ARN, protéines
- XL- b - Chimie supramoléculaire
- XXXIX- Chimie et Synthetic Biology
- XLVI - Du génome au protéome
- 4 - Chimie et médecine
- VIII - Chimie et médecine : d'Hippocrate à Néron
- IX - Chimie et opium : voyages, voyages !
- XVII- Médecine et Chimie à Montpellier avant la Révolution
- XVIII - Le vitalisme de l'Ecole de Montpellier
- XXIX - Le médicament aujourd'hui
- XXVII - Autour de la sérotonine
- XXVIII - L'ocytocine
- XXX - Chimie, médecine, nanotechnologies
- L - Chimie et dopage -1- La chimie au service du dopage
- LI - Chimie et dopage - 2 - Les outils du chimiste contre le dopage
- XLIX - Image magnétique - 3 - de l'IRM au patient numérique
- 5 - La chimie moderne et ses hommes
- XXXI - Mendeleïev : un tableau de maître !
- XXXII - Mendeleïev : -2- Un chimiste russe au XIXème siècle
- XXXIII - Mendeleïev -3- Le fin mot de l'histoire
- XLI - Paul Sabatier, chimiste languedocien, prix Nobel 1912
- XLII - Victor Grignard, prix Nobel 1912
- XLVII - Image magnétique - 1 - Une histoire de spin
- XLVIII - Image magnétique - 2 - Mais que vient faire le chimiste dans cette galère ?
- 6 - Chimie : bonnes et mauvaises pratiques
- XXXVII- Du mauvais usage de la chimie
- XXXVIII- La chimie passe au vert
- Pour conclure
- Postface - Nylon by DuPont de Nemours
- Nylon... - Part A
- Nylon... - Part B
- Nylon... - Part C
- Nylon... - Part D
- La beauté des mathématiques
- Les sciences vers La Science
- La révolution numérique
- CRISPR-Cas9 : l'édition de gènes
- L'ombre de Frankenstein
- VOIR
- RECHERCHE, CONTACT
-1- Deux mots d'histoire

Le tableau ci-dessous est une des dernières moutures du tableau de la classification périodique des éléments, conçu par Dmitri Ivanovitch Mendeleïev.
Dans ce tableau, les groupes ou colonnes apparaissent verticalement.
Chacun des 18 groupes du tableau périodique (plus les groupes des lanthanides et des actinides) constitue un ensemble d'éléments aux propriétés similaires et bien distinctes des groupes voisins.
Par exemple, le groupe 1 - à partir du lithium est celui des alcalins, le groupe 17 celui des halogènes et le groupe 18 celui des gaz rares (ou nobles)...
La période désigne une ligne horizontale du tableau périodique. Les propriétés des éléments varient généralement beaucoup le long
d'une période, mais peuvent être parfois assez similaires (voir métaux
de transition) ou constituer des séries
chimiques complètes, comme les lanthanides (de 57 à 71) et les actinides (de 89 à 103).
Pour arriver à cette version élaborée de la classification des éléments (des atomes) et faire apparaître une périodicité de leurs propriétés chimiques, en fonction du poids (masse) atomique comme Mendeleiëv, de la structure électronique externe aujourd'hui - qui donne les raisons de cette périodicité (qu'il ignorait) -, les hommes de science ont dû peu à peu percer les secrets de la matière.
C'est dire si cette recherche est intimement liée à l'émergence, aux progrès et à la reconnaissance de la chimie en tant que science fondamentale.
Après des siècles de controverses à propos de la notion d'élément chimique, d'atome, de corps simple... puis de tâtonnements autour d'une classification liant la périodicité des propriétés chimiques de ces éléments au poids (ou volume) atomique, Mendeleïev publie en 1869 (il a 35 ans), dans une revue peu connue à l'époque, Zh. Russ. Khim. Obshch., (Russian Journal of Organic Chemistry) - mais avec une traduction très rapide dans les semaines suivantes dans la revue allemande Zeitschrift für Chemie - un article qui fera date dans l'histoire de la chimie :
Mendeleev D. On the Relationship of the Properties of the Elements to their Atomic Weights [in
Russian], Zhurnal, 1869, 1 (2-3), 60-77.
Cette première version sera remaniée en 1871 et publiée en 1872 dans Annalen der Chemie und Pharmacie.
Le savant russe connaîtra la consécration après la découverte d'éléments chimiques inconnus lors de ses publications, mais dont il avait prédit l'existence. Son premier tableau comportait 63 éléments ; un an après sa mort (en 1907) on en comptait 86.
Une si longue histoire...
Depuis la fin du XVIIIème siècle, les tentatives - d’abord timides - pour établir une périodicité des propriétés chimiques des éléments, ont été multiples. Ces recherches accompagnent les débuts de la chimie moderne et les premiers pas de la théorie atomique. Elles aboutissent au tableau dit de Mendeleïev, outil encore incontournable pour tout chimiste.
La notion d’élément chimique
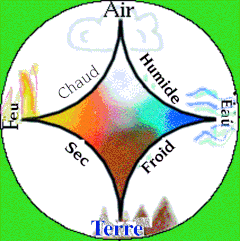
Encore fallait-il avoir une idée précise de la notion d’éléments. J’ai déjà parlé dans ce feuilleton de la théorie atomique de Démocrite, puis de la théorie des 4 éléments d’Empédocle reprise par Aristote.
"Il y a quatre Éléments, le feu, l'eau, la terre et l'air. L'Amitié les rassemble et la Haine les sépare."
A ces 4 éléments sont associées 4 Qualités Élémentales dont l’origine est attribuée au pythagoricien Alcméon de Crotone : le chaud, l’humide, le froid, le sec.
Ce sont les chimistes de la fin du XVIII° siècle, Lavoisier en tête, qui ont donné le nom d’éléments à des entités chimiques « indécomposables »
Antoine LAVOISIER (1743-1794), chimiste français
Lavoisier définit l'atome comme une substance simple qui ne peut être décomposée en d'autres substances, avec en corollaire la loi fondamentale de conservation de la masse de chacune de ces substances simples au cours des réactions chimiques.
Dans son " Traité élémentaire de Chimie » (publié en 1789), il a dressé un tableau de 33 « éléments » connus à son époque, en les regroupant en quatre catégories (les substances simples) sur la base de leurs propriétés chimiques : impalpables (gaz), non-métalliques, métalliques et terreuses.
Cependant ces dernières étaient en fait des oxydes (silice, magnésie, alumine...).
La notion de « poids atomique », la théorie atomique
La notion de masse atomique (poids atomique alors) est abordée par le véritable père de la théorie atomique : le savant anglais John Dalton.

John DALTON (1766-1844), chimiste anglais
Dalton suggère que les particules - ou les atomes - d'un corps simple sont semblables entres elles, mais différentes lorsqu'on passe d'un corps à un autre.
Pour lui une réaction chimique consiste en une nouvelle organisation des atomes dans une substance sans aucune altération. Les atomes sont indestructibles.
C’est en 1803 (selon son journal de laboratoire, le 6 septembre), qu’il propose sa première table des poids atomiques relatifs.
Six éléments apparaissent dans ce tableau, à savoir : hydrogène, oxygène, azote, carbone, le soufre et phosphore. Conventionnellement l'atome d'hydrogène est supposé peser l’unité : 1 (5 pour l'atome d'azote, 7 pour l'atome d'oxygène..).
Dans son cahier, le savant anglais ne précise pas exactement comment il est arrivé à ces valeurs qui résultent sans doute de l’analyse chimique de l’eau, de l’ammoniac, du dioxyde de carbone.
Ces résultats sont présentés dans le célèbre ouvrage : A New System of Chemical Philosophy, publié à Manchester en 1808.
La théorie de Dalton peut être résumée ainsi :
1. La matière est composée de particules infiniment petites et indivisibles appelées atomes.
2. Tous les atomes d'un même élément sont identiques; ils possèdent les mêmes propriétés et ils ont la même masse.
3. Les atomes d'éléments différents ont des propriétés et des masses différentes.
4. Dans les réactions chimiques, les atomes se combinent dans des rapports simples pour former de nouveaux composés (« atomes composés » selon la terminologie de Dalton).
L'atome de Dalton est donc très différent de celui de Démocrite...
Ses propositions s’accordent bien par contre avec celles de Lavoisier et avec la loi des proportions définies, énoncée par Joseph Louis Proust en 1799.
Jöns Jakob BERZELIUS (1779-1848), chimiste suédois
Il fut un des premiers chimistes à accepter la théorie atomique de Dalton. C'est en se fondant sur cette théorie et sur des lois physiques telles que la loi de Gay-Lussac sur les combinaisons des gaz, qu'il dressa le premier tableau des masses atomiques publié en 1818. A cette époque, il avait déjà défini la masse atomique de 45 des 49 éléments connus jusqu'alors.
Il faut noter qu’en 1817, Berzelius découvrit le sélénium et en 1823 le silicium.
Johan DÖBEREINER (1780-1849), chimiste allemand
En 1829 apparaît la notion de groupes avec la loi des triades de Johann Döbereiner.
A la suite de Berzelius, le chimiste allemand est convaincu que les propriétés des éléments sont liées aux poids atomiques.
Dès 1817, Döbereiner observe que trois éléments, chlore, brome et d'iode ont des propriétés chimiques similaires. Il vérifie que le poids atomique du brome est la moyenne arithmétique des poids atomique du chlore et de l'iode.
Il invoque pour ces halogènes la notion de triade. Une triade est un groupe de trois composés aux propriétés chimiques similaires dans lequel les propriétés de l'élément central peuvent être déduites de celles du plus léger et du plus lourd.
Deux autres triades seront mises en avant : calcium-strontium-baryum et soufre-sélénium-tellure.
Jean-Baptiste DUMAS (1800-1884), chimiste français
En 1859, le chimiste français Jean-Baptiste Dumas transforme les triades de Döbereiner en tétrades, en incluant des éléments plus légers (fluor et magnésium).
Il n'utilise plus les moyennes arithmétiques, mais l’incrément entre éléments successifs d’un groupe : environ 16 entre les deux premiers éléments d'une tétrade, puis environ 48 entre les deuxième et troisième éléments et entre les troisième et quatrième éléments :
Fluor = 19 - Chlore = 35,5 (+ 16) - Brome = 80 (+ 45 ) - Iode = 127 (+ 47)
Magnésium = 24 - Calcium = 40 (+ 16) - Strontium = 88 (+ 48) - Baryum = 137 (+ 49)
Parenthèse italienne
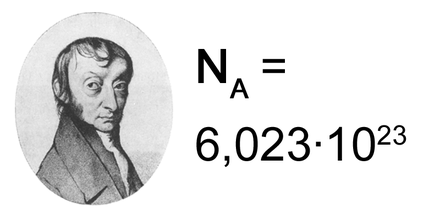
Il faut, à ce moment de l'histoire, mettre en exergue les travaux de deux savants italiens qui ont beaucoup fait pour affiner la
notion de poids atomique, d'atome et de molécule et donner un élan supplémentaire à la théorie atomique.
Amedeo AVOGADRO (1776-1856), chimiste italien
Dalton croyait que le composé le plus simple formé par la réaction de deux éléments ne comportait qu'un atome de chaque espèce (par exemple O pour le gaz oxygène et OH pour l’eau).
L’apport d’Avogadro est immense car il va lever la confusion faite par Dalton entre atomes et molécules (même s’il n’emploie pas ces termes).
Avogadro, en s'appuyant sur la loi de Gay-Lussac relative aux rapports volumiques, découvre que deux volumes égaux de gaz différents, dans les mêmes conditions de température et de pression, contiennent un nombre identique de molécules.
Son mémoire, envoyé à De Lamétherie, éditeur du Journal de physique, de chimie, d'histoire naturelle et des arts à partir de 1785, est publié le 14 Juillet 1811 sous le titre :
" Essai D'une Manière de déterminer les masses des molécules proches des Corps Elémentaires " .
C'est une grande date pour la chimie (il faut noter que le physicien français André-Marie Ampère émet la même hypothèse trois ans plus tard).

Stanislao CANNIZZARO (1826-1910), chimiste italien
Chimiste organicien, révolutionnaire garibaldiste, puis sénateur, Cannizzaro contribue à faire accepter la théorie atomique en clarifiant la distinction entre masse atomique et masse moléculaire en validant les propositions d'Avogadro.
En 1860, à Karlsruhe, au premier Congrès de Chimie, réuni sur le thème « Atomes, molécules, poids atomique, poids moléculaire », on distribue son cours où il montre comment des masses atomiques inconnues d'éléments de composés volatils peuvent être déterminées à partir de masses moléculaires connues d'autres composés.
Il souligne que les masses atomiques des composés non volatils peuvent aussi être déterminées à partir de leurs chaleurs spécifiques (loi de Dulong et Petit) et donc calculables pour des non gaz.
Lothar Meyer (voir plus loin) et Dmitri Mendeleïev étaient à Karlsruhe et sont repartis avec le polycopié de Cannizzaro dans leur poche !
Béguyer de CHANCOURTOIS (1820-1886), géologue français, la vis tellurique
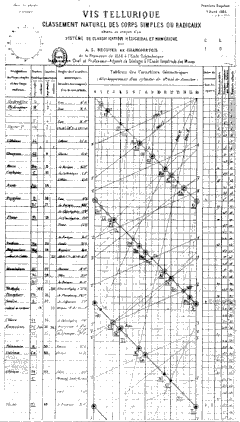
En 1862, Chancourtois propose une classification des éléments basée sur les valeurs des poids atomiques obtenues par Stanislao Cannizzaro en 1858.
C'est le premier scientifique à établir une périodicité des éléments classés dans l'ordre de leurs poids atomiques.
En traçant un graphe des poids atomiques sur la surface d'un cylindre d'une circonférence de 16 unités (le poids atomique de l'oxygène), il obtient une courbe hélicoïdale, qui fait apparaître des éléments similaires sur des points alignés verticalement.
Ce graphe en spirale est appelé vis tellurique, car le tellure se situe au centre du graphique.
Géologue, il n'eut pas grand succès auprès des chimistes...
John Alexander NEWLANDS (1837-1898), chimiste britannique, loi des octaves
Professeur de chimie à l'Ecole de médecine pour femmes de Londres (London School Medicine for Women), c'est le précurseur de la notion de périodes.
Dans son tableau de 1863, les éléments connus à l'époque sont classés de façon séquentielle en 7 groupes, dans l'ordre des poids atomiques.
En 1865, il énonce une loi des octaves indiquant que " tout élément donné va présenter un comportement analogues au huitième élément qui le suit dans le tableau".
Son tableau, comme les précédents comportait quelques irrégularités. Il lui permet cependant de prédire l'existence du germanium (dont il estime le poids atomique à 73) entre le silicium et l'étain.
Parenthèse française : la guerre atomique
En France, comme je l'ai déjà souligné, la généralisation de la notation atomique n’a lieu qu’en 1893 pour l’enseignement secondaire et quelques années plus tard à l'université, alors que les travaux de Cannizzaro avaient permis de rallier depuis longtemps à la notion d'atome une majorité de chimistes organiciens européens.
Nous devons ce retard à Marcellin Berthelot (1827-1907), grand chimiste organicien dont j'ai déjà beaucoup parlé, professeur au Collège de France, mais adepte " idéologique " de la notation équivalentiste.
En 1877 le débat entre les atomistes et les équivalentistes est relancé à l'Académie des sciences, à propos de la dissociation des vapeurs à haute température. Ce phénomène, découvert quelque vingt ans plus tôt par H. Sainte Claire Deville, semble mettre en question l'hypothèse d'Avogadro-Ampère. La discussion s'étend rapidement à tout un ensemble de questions liées à l'atomisme.

A Paris, la notation atomique est adoptée par Wurtz, Friedel, Saler, Naquet, Schutzenberger et d'autres… tandis que la notation en équivalents est préconisée par Berthelot, Sainte Claire Deville, Troost, Lemoine, Bouchardat, etc.
Berthelot reproche à son collègue Wurtz, ardent défenseur de l'atomisme de croire aux atomes comme si on pouvait les voir.
Convaincu que la science peut seulement révéler des rapports entre phénomènes, Berthelot veut en rester aux équivalents qui seuls, à ses yeux, résultent de l'expérience.
Victor Grignard qui reçut le prix Nobel de chimie en 1912 rapporte qu'il lui fut impossible d'obtenir des renseignements sur la notation atomique pendant ses études.
Paul Sabatier, autre prix Nobel français (la même année) -pourtant élève de Berthelot- critique violemment le monopole de l'enseignement des équivalents dans l'enseignement supérieur.
Voir sur le site les articles à propos de Grignard et Sabatier
La censure était si totale que pour institutionnaliser l'enseignement de la notation atomique, les rares défenseurs du système alternatif durent créer une école indépendante sponsorisée par les industriels parisiens et le conseil municipal de Paris : l'Ecole de physique et de chimie industrielle de Paris (ESCPI) ouverte en 1882.
Myriam Scheidecker-Chevallier, Le débat sur les atomes au XIXème siècle (références biographiques rajoutées)
Voir ICI les échos de ce débat rapportés par FLAUBERT dans Bouvard et Pécuchet.
Lothar MEYER (1830-1895), chimiste allemand
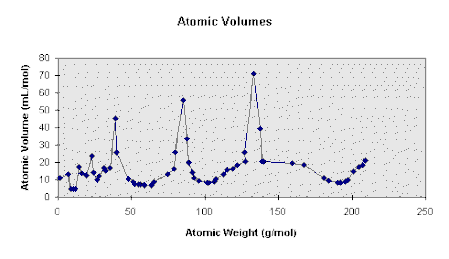
Il a raté la gloire pour quelques mois. En 1870, il publie un tableau périodique comportant 56 éléments. Il s'agit d'un graphe (ci-contre) reliant le volume et le poids atomique. Sur la crête de cette courbe, les pics correspondent à la famille des alcalins (lithium, sodium, potassium...).
Les périodes de Meyer ne sont pas des octaves, elles sont de longueur variable.
Il faut noter que le chimiste allemand avait publié en 1864 une première version du tableau périodique des éléments contenant 28 éléments classés en six familles et ordonné en fonction de leur valence (qui donne le nombre de liaisons possibles d'un atome).
Enfin Dmitri Ivanovitch Mendeleïev vint... et beaucoup de choses se clarifièrent. Le célèbre barbu de Saint-Pétersbourg bénéficia bien sûr du travail de ses prédécesseurs et des avancées décisives de la chimie dans la seconde moitié du XIXème siècle. En particulier des résultats produits par Cannizarro au Congrès de Karsruhe que j'évoquais plus haut.

