- AVANT-PROPOS
- A la UNE
- PRESENTATION
- ACTUALITE SCIENTIFIQUE et TECHNOLOGIQUE
- ACTUALITE ARTISTIQUE
- BLOG
- CONSCIENCE
- PLANETE VIVANTE
- SCIENCES
- Sciences et histoire
- Science et politique
- Science/conscience
- Médecine de demain
- Le COVID-19
- COVID-19 - Journal d'une pandémie - 1 -
- COVID-19 - Journal d'une pandémie - 2 -
- COVID-19 - Journal d'une pandémie - 3 -
- COVID-19 - Journal d'une pandémie - 4 -
- COVID-19 - Journal d'une pandémie - 5 -
- COVID-19 - Journal d'une pandémie -6 -
- COVID-19 - Journal d'une pandémie - 7
- COVID-19 - Journal d'une pandémie - 8
- COVID -19 - Journal d'une pandémie - 9
- COVID-19 - Journal d'une pandémie - 10
- COVID-19 - Journal d'une pandemie - 11
- Arts et sciences
- L'homme debout
- Les débuts de la sagesse
- L'épopée scientifique
- Chimie, vivant... une si longue histoire !
- Introduction : 52 choses que je sais d'elle
- Sommaire
- 1 - Premiers pas
- I - A l'origine
- II - De la tetrasomia et l'alchimie à la chimie moderne
- III - al-kimiya
- IV - Alchimie : de l'aube à la fin de la Renaissance
- V - De l'(al)chimie à la chimie : une question de méthode ?
- VI - L'alchimie selon Newton, première partie
- VII - L'alchimie selon Newton, deuxième partie
- 2 - La chimie des Lumières
- XI - Chimie au siècle des Lumières - Introduction
- XII - Chimie au siècle des Lumières- Les affinités électives
- XIII - Diderot et la chimie
- XIV - Diderot - La chimie, pourquoi ?
- XV- Diderot chimiste
- XVI- La chimie et le Rêve de D'Alembert
- 3 - La chimie du vivant
- X - Chimie et Vivant - Introduction
- XIX - La génération spontanée
- XX - Fermentation : duel à 3 !
- XXI - Stéréochimie : clé du Vivant
- XXII - Homochiralité et origine de la vie
- XXIIc - Origine de la vie : état des lieux... provisoire
- XXIIb - Des biopolymères aux premiers organismes vivants
- XXIII- Stéréochimie et activité biologique
- XXIV - Chimie du cerveau - 1- Un cerveau, trois cerveaux, des cerveaux...
- XXV - Chimie du cerveau - 2 - Les neurotransmetteurs, messagers chimiques
- XXVI- Chimie du cerveau -3- Rôle des différents neurotransmetteurs
- XXXIV - Odorat, Odeurs et parfums
- XXXV- Bonnes et mauvaises odeurs
- XXXVI - Chimie et parfums
- XLIII - Chimie et couleur -1- De colore
- XLIV - Chimie et couleur -2- Couleurs végétales
- XLV - Chimie et couleur -3- : chimiothérapie et colorants
- XL- a - ADN, ARN, protéines
- XL- b - Chimie supramoléculaire
- XXXIX- Chimie et Synthetic Biology
- XLVI - Du génome au protéome
- 4 - Chimie et médecine
- VIII - Chimie et médecine : d'Hippocrate à Néron
- IX - Chimie et opium : voyages, voyages !
- XVII- Médecine et Chimie à Montpellier avant la Révolution
- XVIII - Le vitalisme de l'Ecole de Montpellier
- XXIX - Le médicament aujourd'hui
- XXVII - Autour de la sérotonine
- XXVIII - L'ocytocine
- XXX - Chimie, médecine, nanotechnologies
- L - Chimie et dopage -1- La chimie au service du dopage
- LI - Chimie et dopage - 2 - Les outils du chimiste contre le dopage
- XLIX - Image magnétique - 3 - de l'IRM au patient numérique
- 5 - La chimie moderne et ses hommes
- XXXI - Mendeleïev : un tableau de maître !
- XXXII - Mendeleïev : -2- Un chimiste russe au XIXème siècle
- XXXIII - Mendeleïev -3- Le fin mot de l'histoire
- XLI - Paul Sabatier, chimiste languedocien, prix Nobel 1912
- XLII - Victor Grignard, prix Nobel 1912
- XLVII - Image magnétique - 1 - Une histoire de spin
- XLVIII - Image magnétique - 2 - Mais que vient faire le chimiste dans cette galère ?
- 6 - Chimie : bonnes et mauvaises pratiques
- XXXVII- Du mauvais usage de la chimie
- XXXVIII- La chimie passe au vert
- Pour conclure
- Postface - Nylon by DuPont de Nemours
- Nylon... - Part A
- Nylon... - Part B
- Nylon... - Part C
- Nylon... - Part D
- La beauté des mathématiques
- Les sciences vers La Science
- La révolution numérique
- CRISPR-Cas9 : l'édition de gènes
- L'ombre de Frankenstein
- VOIR
- RECHERCHE, CONTACT
Nylon by DuPont de Nemours
Part B - La saga du nylon
DuPont 1927 : le pari de la recherche

L'entreprise DuPont de Wilmington (Delaware) s'était diversifiée dès le début du XXème siècle en s'orientant vers la chimie de spécialité. Elle produisait notamment des pigments pour la peinture et des colorants.
Elle devait ce nouvel élan à trois jeunes cousins du Pont : T. Coleman, Pierre S. et Alfred I. qui en 1902, un siècle exactement après sa création, rachetèrent l'entreprise à leurs aînés.
Certes ils continuèrent à produire de la dynamite ("Nobel's Blasting Powder") - introduite dans l'entreprise par Lammot du Pont I- et de la poudre. Ils firent en particulier de belles affaires entre 1914 et 1918 !
J'ai indiqué un peu plus haut que la DuPont s'était lancé dans la production de fibres d'acétate dans les années 20.
La première entreprise d'EI du Pont de Nemours and Company en fibres artificielles a vu le jour en 1920 grâce à une prise de participation de 60% dans les Comptoir des Textiles Artificiels, une société française de rayonne, pour 4 millions de dollars.
Cependant, dès cette époque des managers intelligents de la Du Pont avaient compris que l'achat de brevets ne suffisait plus, que l'avenir de la firme passait par le développement de la recherche.
Ainsi, en décembre 1926, Charles MA Stine, le directeur du département de chimie de DuPont, dans une note au comité exécutif de l'entreprise, réclame des investissements dans un «travail scientifique pur» .
Stine soutient que la DuPont devrait financer des laboratoires axés sur «l'établissement ou la découverte de nouveaux faits scientifiques». En cela il est plus radical que la General Electric ou Bell Telephone qui ont ouvert de telles structures, prudemment qualifiées de laboratoires de recherche industrielle pour ne pas faire fuir les actionnaires.
De la recherche « pure »ou« fondamentale » dans une entreprise axée sur le profit, c'était une idée assez radicale. Elle fit la fortune de la DuPont et de l'Amérique.
En effet, le comité exécutif valida la proposition de Stine en mars 1927. Il reçut 25 000 $ par mois pour la recherche "pure", l'autorisation d'embaucher 25 des meilleurs chimistes qu'il pouvait trouver. De plus, l'entreprise débloqua les fonds pour la construction d'un nouveau laboratoire, bientôt baptisé «Purity Hall» par les chimistes de DuPont...
... pas mal !
Quatre domaines furent choisis : la chimie des colloïdes, la catalyse, la synthèse organique, la polymérisation, auxquels il faut ajouter un département d'étude physico-chimiques.
Le plus compliqué fut de recruter ces 25 brillants chercheurs. Les universitaires américains doutaient de l'intention réelle de l'industriel.
Stine rencontra donc beaucoup plus de difficultés à attirer des chimistes chez DuPont qu'il ne l'avait prévu.
Cependant, an plus tard, le recrutement spectaculaire de Wallace H. Carothers, un jeune professeur de chimie organique de Harvard, fut un coup de maître ; elle débloqua la situation.
Ce recrutement n'était pas sans risque car le projet de Carothers concernait les polymères et la polymérisation, domaine fort mal connu et peu prisé des chimistes de haut niveau.
Carothers croyait dur comme fer à la théorie de Staudinger sur les macromolécules (voir plus haut) et à l'avenir des polymères. En le recrutant La DuPont avait fait un deuxième pari gagnant.
D'après : Nylon 6,6, Molecules Than Matter
W.H. Carothers
Le scientifique, l'homme névrosé

Wallace Hume Carothers fut donc la première prise de guerre de la EI DuPont de Nemours parmi les universitaires. Il est recruté à Harvard en 1927. Il prend la direction d'une petite équipe de polyméristes en février 1928.
WH Carothers est né en 1896 dans l'Iowa au sein d'une modeste famille présbytérienne. Après des études classiques en chimie durant lesquelles son talent d'expérimentateur est remarqué, il soutient sa thèse en 1924 à l'université de l'Illinois. Son patron le présente alors comme le meilleur chimiste organicien du pays.
Depuis le début de ses études supérieures, Carothers a occupé diverses positions d'assistant professeur dans les université du Dakota du Sud et de l'Illinois. En 1926, il est recruté par la prestigieuse université d'Harvard.
Malheureusement le brillant chimiste souffre de troubles névrotiques graves qui lui font redouter le contact avec le public et donc rendent très pénible son activité d'enseignant. L'homme n'est heureux que dans son laboratoire. Ceci explique en parti son départ pour la DuPont, peu de temps après (le fait que son salaire ait été doublé a sans doute aussi aidé le débauchage !).
Sa maladie hélas le conduira au suicide : le 28 avril 1937 il avale une capsule de cyanure avec un jus de citron... bon chimiste jusqu'à la fin.
Il n'aura donc pas connu le succès fabuleux du nylon. Son élection à la prestigieuse Académie Nationale des Sciences des Etats-Unis (NAS)
en 1936 aura été sans doute pour lui un grand moment de satisfaction.
La découverte du nylon

Je l'ai dit plus haut, Carothers adhérait complètement à la thèse de Staudinger et de l'Ecole allemande.
Alors que le grand Emil Fischer croyait que les valeurs élevées obtenues pour les masses molaires de polymères comme le caoutchouc ou des produits naturels (cellulose, amidon, protéines...) étaient des valeurs apparentes dues à l'agrégation de petites molécules en particules colloïdales, dès 1920, Staudinger affirmait que le caoutchouc était une longue chaîne constituée de courtes unités répétées, reliées par des liaisons covalentes.
Et c'est bien cette hypothèse que Carothers va vérifier en réalisant des polycondensations, c'est à dire la synthèse de polymères par création de liaisons covalentes. S'il n'a pas vu le succès commercial de son travail, il aura au moins eu la satisfaction de voir valider ses idées scientifiques.

Le premier objectif de l'équipe de Carothers est de préparer des macromolécules de très haut poids moléculaire. Il choisit la polycondensation à partir d'un diol et d'un diacide.
En avril 1930, Julian W. Hill, membre du groupe, produit ainsi un premier polyester de très haute masse moléculaire (environ 12 kDa).
Malheureusement les fibres obtenues à partir de ce polymère -de trop bas point de fusion- ont de très mauvaises qualités mécaniques.
Cependant nous sommes à l'époque du grand bond en avant dans l'automobile ; la célèbre Ford T a fait un tabac ; plus de 16 millions d'exemplaires vendus entre 1909 et 1928 !
Cela n'échappe pas au nouveau supérieur hiérarchique de Carothers, le Dr. Elmer K. Bolton. En janvier 1930, il lui demande d'examiner le moyen de synthétiser un caoutchouc synthétique. En avril 1930, un chimiste du laboratoire, Arnold M. Collins, isole le chloroprène, liquide qu'il polymérise pour former un matériau solide qui ressemble au caoutchouc. C'est le polychloroprène, aujourd'hui Néoprène.

Mais Carothers n'a pas renoncé aux polycondensats, il change son fusil d'épaule, abandonne les polyesters et lance son équipe sur la fabrication de polyamides.
C'est un autre membre du groupe, Donald D. Coffman qui pilote les tentatives sur le sujet. Après de nombreux essais, il s'avère que la condensation d'une diamine (hexaméthylène diamine) avec un diacide (acide adipique) fournit un polycondensat de haute qualité. C'est le fameux nylon 66. (PA 66, 6 étant le nombre de carbone des deux réactants).
C’est un comité de l’entreprise DuPont de Nemours qui donna en 1939 un nom à ce polyamide ; partant de "norun" ("no run", c’est-à-dire : "ne file pas"), il serait passé par "Nuron" (inversion pour éviter des attaques judiciaires de concurrents) puis "Nylon", plus facile à prononcer et rappelant deux autres matières textiles, le coton et la rayonne (rayon en anglais).
C'est un ingénieur français (naturalisé américain), Gérard Berchet, qui avait déjà mis au point le néoprène, qui procéda à la première polycondensation au laboratoire. Nous sommes le 28 février 1935.
Voici un extrait de son cahier de laboratoire :
Adipate d'hexaméthylène diamine
7 g. diamine, 8,8 g. acide et 20 cc. m-crésol chauffé à 215 ° pendant 3 heures. L'eau s'est détachée pendant la première demi-heure. Le temp. a ensuite été porté à 255-60 ° et le crésol distillé dans le vide. Le résidu s'est solidifié en une fois mais a ensuite fondu à nouveau à 265 °. Il a été chauffé sous 1 mm à 265 ° pendant 3 heures. Au refroidissement (pendant une nuit), le polymère a rompu le flacon en se contractant et a montré une adhérence tenace au verre.
C'était un solide très dur et corné fondant à 252-254 °. C'était très facilement filable. Échantillon remis à DD Coffman.
On a obtenu 12,5 g. de polymère, rendement 90%.
3/1/35 GJB 3/21/35 HB Dykstra

A noter que Wallace Carothers a souhaité explorer les principes fondamentaux de la polymérisation (la cinétique par exemple) et leur corrélation avec les propriétés des polymères obtenus.
Pour cela, en 1934, il s'adjoignit les services de Paul J. Flory (1910-1985) qui venait d'obtenir un doctorat en chimie physique à l'Ohio State University.
Il avait eu le nez creux puisque son brillant assistant obtint le prix Nobel de chimie en 1974 ("pour ses travaux en physico-chimie des macromolécules") et la médaille Priestley de l'American Chemical Society la même année !
Trois ans après Carothers, Paul Schlack à l'IG Farben (Allemagne) mettait au point un nylon 6 - le polycaprolactame (PA 6) - baptisé Perlon.
Le succès du Nylon 66 et du Perlon ne s'est jamais démenti, même si l'arrivée de nombreux concurrents leur taillera quelques croupières.
En novembre 2000, le site près de Wilmington, où Carothers a réalisé ses travaux sur les polymères, a été nommé International Historic Chemical Landmark par l'American Chemical Society.
Les propriétés remarquables du nylon 66
Le nylon 66 (ou polyamide 66 : PA 66) est l'un des polymères thermoplastiques les plus polyvalents, il est devenu très rapidement la référence pour les fibres textiles et les pièces moulées, domaines dans lesquels il est encore très largement utilisés.
Il présente une résistance mécanique élevée, une forte rigidité tout en ayant une bien meilleure élasticité que les fibres naturelles, une bonne stabilité à la chaleur (son point de fusion est supérieur à 260°C) et aux UV ainsi qu'une bonne inertie chimique.
De plus le nylon 66 est très facile à colorer et à formuler avec différents additifs, fibres, lubrifiants internes ou modificateurs d'impact.
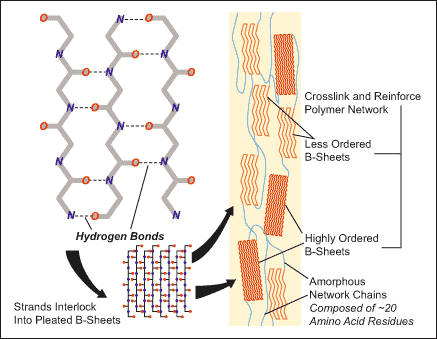
En synthétisant des polyamides, Carothers a fait du biomimétisme avant l'heure. Ce sont en effet les nombreuses "liaisons hydrogène" qui s'établissent entre les chaînes qui assurent la cohésion, la solidité, du polymère. Grâce à elles les nylons ont une structure semi-cristalline (65% de zone cristalline dans le Nylon 66).
La nature utilise ces mêmes interactions non covalentes pour former des structures tridimensionnelles bien définies, par exemple dans les protéines, l'ADN, l'ARN... et les fibres naturelles comme la soie.
Ainsi, les fibroines, qui sont des protéines principalement constituées de séquences récurrentes d'acides aminés ( Gly - Ser -Gly- Ala -Gly-Ala)n , ont une structure secondaire en feuillet bêta qui est à l'origine des propriétés mécanique de la soie. Elle est due à ces mêmes liaisons non covalentes, de faible énergie - les liaisons "hydrogène" - qui assurent la cohésion entre les chaînes.
J'ai indiqué sur ce site que ces interactions non covalentes ont une part déterminante dans la complexité biologique et les mécanismes du vivant. Les chimistes du vivant se sont inspirés de ces mécanismes naturels pour développer la chimie supramoléculaire.



