- A la UNE
- ACTUALITE SCIENTIFIQUE et TECHNOLOGIQUE
- BLOG
- PRESENTATION
- CONSCIENCE
- PLANETE VIVANTE
- SCIENCES
- Sciences et histoire
- Science et politique
- Science/conscience
- Le COVID-19
- COVID-19 - Journal d'une pandémie - 1 -
- COVID-19 - Journal d'une pandémie - 2 -
- COVID-19 - Journal d'une pandémie - 3 -
- COVID-19 - Journal d'une pandémie - 4 -
- COVID-19 - Journal d'une pandémie - 5 -
- COVID-19 - Journal d'une pandémie -6 -
- COVID-19 - Journal d'une pandémie - 7
- COVID-19 - Journal d'une pandémie - 8
- COVID -19 - Journal d'une pandémie - 9
- COVID-19 - Journal d'une pandémie - 10
- COVID-19 - Journal d'une pandemie - 11
- Arts et sciences
- L'homme debout
- Les débuts de la sagesse
- L'épopée scientifique
- Chimie, vivant... une si longue histoire !
- Introduction : 52 choses que je sais d'elle
- Sommaire
- 1 - Premiers pas
- I - A l'origine
- II - De la tetrasomia et l'alchimie à la chimie moderne
- III - al-kimiya
- IV - Alchimie : de l'aube à la fin de la Renaissance
- V - De l'(al)chimie à la chimie : une question de méthode ?
- VI - L'alchimie selon Newton, première partie
- VII - L'alchimie selon Newton, deuxième partie
- 2 - La chimie des Lumières
- XI - Chimie au siècle des Lumières - Introduction
- XII - Chimie au siècle des Lumières- Les affinités électives
- XIII - Diderot et la chimie
- XIV - Diderot - La chimie, pourquoi ?
- XV- Diderot chimiste
- XVI- La chimie et le Rêve de D'Alembert
- 3 - La chimie du vivant
- X - Chimie et Vivant - Introduction
- XIX - La génération spontanée
- XX - Fermentation : duel à 3 !
- XXI - Stéréochimie : clé du Vivant
- XXII - Homochiralité et origine de la vie
- XXIIc - Origine de la vie : état des lieux... provisoire
- XXIIb - Des biopolymères aux premiers organismes vivants
- XXIII- Stéréochimie et activité biologique
- XXIV - Chimie du cerveau - 1- Un cerveau, trois cerveaux, des cerveaux...
- XXV - Chimie du cerveau - 2 - Les neurotransmetteurs, messagers chimiques
- XXVI- Chimie du cerveau -3- Rôle des différents neurotransmetteurs
- XXXIV - Odorat, Odeurs et parfums
- XXXV- Bonnes et mauvaises odeurs
- XXXVI - Chimie et parfums
- XLIII - Chimie et couleur -1- De colore
- XLIV - Chimie et couleur -2- Couleurs végétales
- XLV - Chimie et couleur -3- : chimiothérapie et colorants
- XL- a - ADN, ARN, protéines
- XL- b - Chimie supramoléculaire
- XXXIX- Chimie et Synthetic Biology
- XLVI - Du génome au protéome
- 4 - Chimie et médecine
- VIII - Chimie et médecine : d'Hippocrate à Néron
- IX - Chimie et opium : voyages, voyages !
- XVII- Médecine et Chimie à Montpellier avant la Révolution
- XVIII - Le vitalisme de l'Ecole de Montpellier
- XXIX - Le médicament aujourd'hui
- XXVII - Autour de la sérotonine
- XXVIII - L'ocytocine
- XXX - Chimie, médecine, nanotechnologies
- L - Chimie et dopage -1- La chimie au service du dopage
- LI - Chimie et dopage - 2 - Les outils du chimiste contre le dopage
- XLIX - Image magnétique - 3 - de l'IRM au patient numérique
- 5 - La chimie moderne et ses hommes
- XXXI - Mendeleïev : un tableau de maître !
- XXXII - Mendeleïev : -2- Un chimiste russe au XIXème siècle
- XXXIII - Mendeleïev -3- Le fin mot de l'histoire
- XLI - Paul Sabatier, chimiste languedocien, prix Nobel 1912
- XLII - Victor Grignard, prix Nobel 1912
- XLVII - Image magnétique - 1 - Une histoire de spin
- XLVIII - Image magnétique - 2 - Mais que vient faire le chimiste dans cette galère ?
- 6 - Chimie : bonnes et mauvaises pratiques
- XXXVII- Du mauvais usage de la chimie
- XXXVIII- La chimie passe au vert
- Pour conclure
- Postface - Nylon by DuPont de Nemours
- Nylon... - Part A
- Nylon... - Part B
- Nylon... - Part C
- Nylon... - Part D
- La beauté des mathématiques
- Les sciences vers La Science
- La révolution numérique
- CRISPR-Cas9 : l'édition de gènes
- L'ombre de Frankenstein
- VOIR
- RECHERCHE, CONTACT
L'humanité n'a pas attendu la chimie moderne et la fin du XIXème siècle pour essayer de traiter les maladies qui affectaient nos ancêtres.
Les hommes de l'Art se tournaient alors soit vers la philosophie (médecine chinoise par exemple), soit vers la Nature qui fournissait en abondance toute sorte de plantes, souvent parées (à tort ou à raison) de vertus thérapeutiques multiples. Plantes qui ont permis aussi, très tôt, de régler quelques querelles familiales !

Le culte du Naturel, la mode des philosophies orientales, les déplorables conséquences de traitements chimiques inconsidérés, ont
remis à la mode une médecine traditionnelle - dite douce ou alternative - qui fait la fortune de quelques charlatans, mais aussi d'entreprises multimillionnaires qui abusent de la
crédulité humaine, avec malheureusement la complicité passive (ou active dans certains pays) des autorités politiques.

L'article ci-après analyse de façon pertinente les causes de ce retour au passé. Voici son introduction :
"Rien n'est plus puissant qu'une idée, et rien de plus potentiellement nuisible qu'une fausse idée ou une idée reçue que tout le monde considère comme vraie sans jamais la remettre en question ne serait-ce qu'un instant, ou tout simplement la vérifier.
La popularité actuelle de la médecine dite "alternative" en général, et les remèdes à base de plantes en particulier, reposent sur plusieurs mythes communément acceptés dont le principal, le chef de file, est l'idée selon laquelle tout ce qui est "naturel" est bon.
Ces mythes, pourtant, ne tiennent pas face à un examen critique minutieux. Ils fleurissent parce qu'ils touchent à une corde sensible de la psychologie humaine. L'industrie multimillionnaire des produits diététiques se sert de ces mythes comme d'un fabuleux plan marketing, et les utilise pour les consolider chez le public à un point tel qu'ils en sont devenus un élément à part entière de la culture."
Conclusion : pas de traitement -quel qu'il soit- sans avis médical, un produit "naturel" peut être beaucoup plus toxique qu'un médicament !
Des plantes au médicament
Les vertus thérapeutiques des plantes sont connues depuis la préhistoire.
La phytothérapie, ou soin des maladies par les plantes, est aujourd'hui une discipline à part entière.
Même dans la pharmacopée classique, les plantes restent au coeur des médicaments. Ou, plutôt, leurs principes actifs, ces molécules aptes à corriger déséquilibres ou dysfonctionnements dans l'organisme. Près de 50 % des produits thérapeutiques commercialisés ont une origine naturelle.
On estime que sur les 250 000 à 300 000 espèces recensées, environ 35 000 possèdent des propriétés médicinales. Or, jusqu'à présent, seulement 5 000 ont été étudiées !
Nous avons vu que l'utilisation directe de la plante médicinale n'était pas sans risque du fait de la présence dans les extraits de plusieurs types de molécules bioactives susceptibles, soit d'avoir des effets néfastes sur l'organisme, soit d'interagir avec d'autres médicaments. De plus le dosage requis pour obtenir l'efficacité optimale n'est pas toujours vérifié.
On a donc appris, depuis le XXe siècle, à isoler ces principes actifs, à les extraire et à les transformer.
Une nouvelle étape a été franchie depuis que l'on sait modifier un végétal par génie génétique, afin qu'il produise le principe actif désiré à grande échelle et en toute sécurité sanitaire.

La création de médicaments nécessite néanmoins la mise en oeuvre de procédés complexes, longs et coûteux : il faut définir la molécule susceptible d'agir, puis la trouver. Si elle existe déjà, par exemple dans une plante, elle doit être purifiée afin d'éliminer toute trace des autres composants.
Néanmoins la recherche de nouveaux médicaments passe aujourd'hui largement par la chasse aux trésors de nouvelles espèces végétales figurant dans les pharmacopées traditionnelles. De grands groupes pharmaceutiques envoient ainsi dans les coins les plus reculés de la planète un nouveau type d'explorateurs : des bataillons de botanistes, chimistes, biologistes ...!
L'institut de Chimie des Substances Naturelles (ICSN ), à Gif sur Yvette, et le professeur Pierre Potier (qui disait souvent : « La chimie est à la biologie ce que le solfège est à la musique ») furent des précurseurs dans ce domaine des "chercheurs-crapahuteurs".
Après leurs travaux sur la pervenche de Madagascar, qui aboutit à la mise sur le marché de la Navelbine (utilisé dans le traitement du cancer du poumon et du cancer du sein) avec le concours des laboratoires Pierre Fabre, Pierre Potier et ses collaborateurs sont à l'origine de la synthèse du Taxotère, médicament majeur dans le traitement du cancer du sein.

L'If, du poison au médicament anticancéreux
De la famille des Taxacées, l'if est souvent utilisé comme arbre d'ornement pour sa facilité d'entretien et sa longévité remarquable.
Il pousse spontanément dans les régions tempérées ou subtropicales. Deux espèces sont utilisées à des fins thérapeutique, le
Taxus
brevifolia ou if américain, ou le Taxus baccata, ou if européen.
Déjà dès l’Antiquité, Pline mettait en garde les vignerons contre l’usage des tonneaux en bois d’if pour garder le vin. On empêche toujours les vaches et les chevaux de goûter aux feuilles d’if qui est donc connu comme un arbre toxique.
Dans les années 60, suite à une campagne du National Cancer Institute, le botaniste Arthur S. Barclay recueille des lamelles d’écorce d’ifs qui, en 1964, font l’objet d’extraits et de tests par MC. Wani.
Une activité sur des cellules tumorales est détectée et MC. Wani réussit à isoler la molécule responsable en 1971. Elle est baptisée taxol ; sa structure est publiée en 1972.
Compte tenu des difficultés d’approvisionnement (aux Etats-Unis, 12000 arbres sont abattus à la grande colère des écologistes pour produire 2 kilos de taxol nécessaires aux essais cliniques) et de solubilité, la molécule est négligée un certain temps jusqu’à ce qu’en 1979, S. Horwitz élucide le mécanisme d’interaction : la molécule taxol s’accroche aux microtubules, bloquant ainsi la division cellulaire.
L’intérêt est relancé et en 1983, les essais cliniques montrent son activité dans le traitement des cancers de l’ovaire, du sein et des poumons. Cependant, l’approvisionnement par l’écorce de l’if du Pacifique reste un problème crucial, puisque après une campagne d’abattage, huit tonnes d’écorces n’avaient produit que 1 300 g de taxol. C’était évidemment un défi scientifique lancé aux chimistes, et près d’une trentaine d’équipes de recherche de par le monde se lancent sur la piste de la synthèse du taxol.
En France en 1980, le professeur Pierre Potier et son équipe de l'Institut de Chimie des Substances Naturelles de Gif-sur-Yvette, s'intéressent à l'if européen.
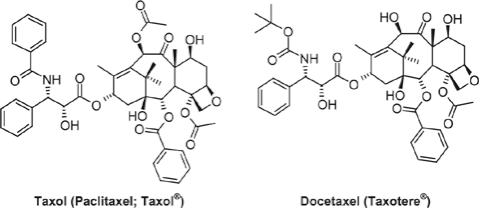
Le TAXOTERE
Fin 1979, la municipalité de Gif avait négocié avec le CNRS le passage d’une route dans une partie du parc du campus et plusieurs ifs européens centenaires avaient été abattus.
Aubaine pour Daniel Guénard, "champion du test à la tubuline", qui avec la bénédiction de Pierre Potier recueille les aiguilles, broie les branches, pile les fruits et désosse les racines, fabrique de multiples extraits et trouve une substance modérément active au test, sous le nom de 10-DAB.
Elle diffère du taxol par une chaîne latérale. Pierre Potier et son équipe se lancent dans le greffage chimique de cette chaîne.
Après de multiples essais, ils échouent dans la synthèse du taxol, mais isolent 12 mg d’un composé intermédiaire : le N-dibenzoyl- N-ter-butoxycarbonyl-10-déacetyl taxol, deux fois plus actif que le taxol au test tubuline ! Le Taxotère® est né.
Cette fois, Rhône-Poulenc qui était partenaire de l’ICSN sur l’étude de l’if et du thuya, complétait les évaluations par des tests in vivo des molécules fournies par les chercheurs du CNRS, parmi lesquelles figurait le Taxotère®.
En 1990, les essais cliniques peuvent débuter en France, au Royaume-Uni et aux États-Unis ; ils confirment la bonne activité anticancéreuse du produit.
En 1995, quinze ans après les premières recherches sur l’if, l’AMM est obtenue en Europe et aux États-Unis. Actuellement, c’est un « blockbuster » : ce médicament fait partie des cinq anticancéreux les plus vendus au monde, dans plus de 86 pays.
Voir article complet de Jean-Claude Bernier, L’actualité chimique, juillet 2006
VOIR
Cours de Stéphane Quideau, " La chimie organique dans la conception de médicaments..."
Criblage à haut débit et synthèse combinatoire
De la découverte d'un nouveau médicament jusqu'à l'AMM, le processus de l'innovation thérapeutique

La recherche et le développement sont deux activités clés des entreprises du médicament. Ces recherches sont longues et coûteuses.
Dans le cadre d'une recherche et développement classique, sur 10.000 molécules qui sont " screenées ", en tant que nouveaux médicaments potentiels, les tests de laboratoire identifient environ une quinzaine de molécules candidates pour des études précliniques. Après l'évaluation de ces molécules chez l'animal, quelques-unes d'entre elles sont étudiées en clinique chez l'Homme, et seules une ou deux arrivent à l'ultime étape : l'autorisation de mise sur le marché (AMM).
Entre le moment de la conception d'une nouvelle molécule et le moment où elle est susceptible d'arriver sur le marché, il faut compter de sept ans à douze ans. Par ailleurs, des nouveaux procédés tels que la biotechnologie, la chimie combinatoire, peuvent diminuer les délais et coût de la recherche

La recherche : quatre grandes voies
Il existe quatre grandes voies classiques de recherche :
1. L'extraction d'une substance à partir de produits naturels de différentes origines, végétales, animales ou minérales (voir ci-dessus).
2. La synthèse chimique des molécules à partir de radicaux dont on connaît - ou suppose - les propriétés thérapeutiques ; ces molécules imitent, renforcent ou inhibent des activités biologiques.
La synthèse peut être totale (fabrication à partir d'"éléments" chimiques) ou partielle : on utilise alors une molécule ou une fraction de molécule qu'on "module". La synthèse peut aboutir soit à une substance artificielle totalement inconnue jusqu'alors, soit à une molécule analogue à une molécule naturelle.
3. La création et production de substances biologiques par les biotechnologies..
4. La modélisation de molécules thérapeutiquement actives.

La démarche de ce nouveau concept comporte un certain nombre d'étapes, dont la première est la détermination de la structure tridimensionnelle d'une substance, qui au sein de l'organisme, agit à un niveau précis du développement d'une maladie.
La seconde étape consiste à "créer" une molécule dont la structure est en parfaite adéquation avec celle de la cible de la substance concernée.
Une autre approche fait appel à la même démarche mais consiste à "prendre une empreinte" de cette cible et à "fabriquer" d'après un "moulage" la molécule susceptible d'agir.

Un autre type de recherche est la forme galénique qui permet d'améliorer ce qui existe déjà en étudiant de nouveaux modes d'administration plus adaptés, plus efficaces, mieux tolérés, plus faciles d'emploi.
Ces dernières années ont vu l'arrivée de formes retards, de patch, de transporteurs nouveaux, tels les liposomes, les implants, permettant des avancées thérapeutiques parfois importantes.
Enfin, les nouvelles voies de recherche sont aussi représentées par les thérapies géniques (transfert de gènes à des patients à des fins diagnostiques ou thérapeutiques dans le but de compenser une anomalie génétique, de modifier les fonctions de la cellule ou d'induire un suicide de la cellule cible) ,les thérapies cellulaires (injection de cellules transformées par des procédés " pharmacologiques " à des êtres humains, dans le but de prévenir, traiter ou atténuer une maladie). Ces deux types de thérapies bénéficient d'un cadre juridique spécifique.
Les nouvelles technologies (chimie combinatoire, biotechnologies) permettent certes un gain de temps parfois important en termes de recherche et de production, mais le développement reste lourd et cher.


Le criblage à haut débit est une opération qui met en œuvre des robots capables d’accélérer et d’automatiser des étapes de mise en contact de molécules potentiellement actives en pharmacologie (candidats médicaments) avec un système biologique qui reproduit certains aspects de la vie d’une organisme vivant ou de son dérèglement (maladie).
Ce criblage est dit à haut débit car le processus est très rapide. Il permet de tester des dizaines voire des centaines de milliers de molécules (en provenance de la nature ou de la synthèse chimique) avec des cibles pharmacologiques en très peu de temps (quelques semaines voire quelques jours).
C’est une formidable accélération des capacités d’analyse de l’intérêt de molécules actives. Il faut toutefois ensuite analyser la pertinence de la génération de ces millions de résultats, ce qui demande d’autres instruments en cours d’élaboration par l’industrie pharmaceutique.
Cette technologie est issue des progrès de la biologie moléculaire, de l’informatique, de la robotique et de la miniaturisation. Depuis le début des années 90, il est devenu une technique clef de l’industrie pharmaceutique. Ceci oblige bien naturellement à envisager d’autres sources de matières à tester et l’approche traditionnelle doit être complétée par une approche de masse comme la collecte de nombreux végétaux ou la synthèse combinatoire.
En synthèse combinatoire une famille de synthons A1, A2, A3,… réagit avec une famille de réactifs B1, B2, B3… les composés obtenus réagissent à leur tour sur une nouvelle famille C1, C2, C3…et ainsi de suite. On obtient donc par toutes les combinaisons possibles, très rapidement, un mélange d’un grand nombre de molécules.
Ce mélange constitue une bibliothèque (library). La bibliothèque est ensuite évaluée globalement par les techniques du criblage à haut débit.
Ces méthodes sont tout à fait adaptées à des synthèses automatisées sur support solide (par exemple synthèse peptidique). Des robots sont aujourd’hui capables de produire des milliers de molécules par jour.
On voit donc le grand intérêt de cette méthode : dans les méthodes classiques on consacre beaucoup de temps à synthétiser et à caractériser des molécules sans savoir si elles auront les propriétés recherchées. Dans la synthèse combinatoire on ne s’intéresse qu’aux molécules dont on sait déjà qu’elles ont une activité.
Métabolisme des plantes : leçons thérapeutiques
Sous le titre Green pathways, la revue
Science propose une série d'articles qui montre ce que peut apporter l'étude de ces voies métaboliques, dans le domaine
thérapeutique, mais aussi agricole, nutritionnel...
Sur quelques problèmes de santé
" Bon, mauvais" cholestérol : du pipeau... ou presque ?

On peut lire un peu partout ce que nos médecins apprennent à ce sujet : les lipoprotéines de haute densité (high density lipoprotein, HDL, densité d'environ 1,1 à 1,2 par rapport à l'eau), responsables du transport du cholestérol vers le foie où il est éliminé, empêchent l'accumulation du cholestérol dans les vaisseaux sanguins et limitent les risques d'athérosclérose.
De nombreux chercheurs mettaient en doute une affirmation aussi simpliste.
Selon une étude publiée dans le Journal of the American Heart Association, l'apolipoprotéine C-III, connue pour ses propriétés pro-inflammatoires, est présente à la surface des lipoprotéines athérogènes, LDL et VLDL, mais également sur certains sous-types de lipoprotéines HDL.
Dans le HDL-cholestérol, il y aurait donc le bon cholestérol, sans apolipoprotéine C-III, et le mauvais, avec cette même apolipoprotéine.
Le résultat est spectaculaire : 20% de la population (*) ayant les taux les plus élevés de HDL-cholestérol avec apolipoprotéine C-III avaient un sur-risque cardiovasculaire de 60% par rapport au reste de la population, toutes choses étant égales par ailleurs.
Pour les auteurs, l’évaluation du risque cardiovasculaire nécessite donc de différencier le HDL-cholestérol avec ou sans apolipoprotéine C-III.
(*) : 572 femmes et 699 hommes suivis pendant 10 à 14 ans

